تبریز امروز:
تاریخ انتشار: 22 اگوست 2024 
پیری یک فرآیند بیولوژیکی است که هیچ کس نمی تواند از آن اجتناب کند. در حالت ایده آل، پیر شدن باید زمانی برای استراحت و لذت بردن از ثمره کارتان باشد. با این حال، پیری جنبه تاریک تری نیز دارد، اما اغلب با بیماری مرتبط است.
در هر ثانیه، سلولهای شما میلیاردها واکنش بیوشیمیایی را انجام میدهند که عملکردهای ضروری برای زندگی را تامین میکند و یک شبکه متابولیک بسیار به هم پیوسته را تشکیل میدهد. این شبکه سلولها را قادر میسازد تا رشد کنند، تکثیر شوند و خود را ترمیم کنند و اختلال در آن میتواند باعث روند پیری شود.
اما آیا پیری باعث کاهش متابولیک می شود یا اختلال متابولیک پیری را تسریع می کند؟ یا هر دو؟
برای پاسخ به این سوال مرغ یا تخم مرغ، ابتدا باید بدانید که چگونه فرآیندهای متابولیک در طول پیری و بیماری شکسته می شوند. من یک دانشمند و محقق هستم و آزمایشگاه من بر کاوش در رابطه پیچیده بین متابولیسم، استرس و پیری تمرکز دارد. در نهایت، ما امیدواریم که این کار راهبردهایی برای ارتقای پیری سالمتر و زندگیهای پرنشاطتر ارائه دهد.
ارتباط بین متابولیسم و پیری
افزایش سن مهم ترین عامل خطر برای بسیاری از شایع ترین بیماری های جامعه از جمله دیابت، سرطان، بیماری های قلبی عروقی و اختلالات عصبی است. یک عامل کلیدی در پس شروع این مشکلات سلامتی، اختلال در هموستاز سلولی و متابولیک یا تعادل است. بر هم زدن هموستاز محیط داخلی بدن را بیثبات میکند و منجر به عدم تعادل میشود که میتواند منجر به مجموعهای از مشکلات سلامتی شود، از جمله اختلالات متابولیک، بیماریهای مزمن و اختلال در عملکرد سلولی که به پیری و سایر شرایط جدی کمک میکند.
متابولیسم مختل با بسیاری از نشانه های سلول های پیر، مانند کوتاه شدن تلومر، که آسیب به انتهای محافظ کروموزوم ها است، و بی ثباتی ژنومی، تمایل به ایجاد جهش های ژنتیکی مرتبط است.
متابولیسم را می توان به دو فرآیند کلی تقسیم کرد: آنابولیسم یا ساختن مولکول ها و کاتابولیسم یا شکستن مولکول ها.
متابولیسم ناکارآمد نیز با عملکرد ضعیف میتوکندری مرتبط است. پیری سلولی، یا زمانی که سلولها تقسیم نمیشوند. عدم تعادل در میکروب های روده؛ و کاهش توانایی سلول ها برای تشخیص و پاسخ به مواد مغذی مختلف.
اختلالات عصبی، مانند بیماری آلزایمر، نمونه های بارز بیماری های مرتبط با افزایش سن با ارتباط قوی بین متابولیسم نامنظم و کاهش عملکرد هستند. به عنوان مثال، تیم تحقیقاتی من قبلاً کشف کرده بود که در موش های پیر، توانایی سلول های مغز استخوان برای تولید، ذخیره و استفاده از انرژی به دلیل افزایش فعالیت پروتئینی که التهاب را تعدیل می کند، سرکوب می شود. این وضعیت کمبود انرژی منجر به افزایش التهاب می شود که با تکیه سلول های پیر به گلوکز به عنوان منبع اصلی سوخت آنها بدتر می شود.
با این حال، مهار آزمایشی این پروتئین در سلولهای مغز استخوان موشهای پیر، توانایی سلولها را برای تولید انرژی احیا میکند، التهاب را کاهش میدهد و انعطافپذیری ناحیهای از مغز که درگیر حافظه است را بهبود میبخشد. این یافته نشان می دهد که برخی از پیری شناختی را می توان با برنامه ریزی مجدد متابولیسم گلوکز سلول های مغز استخوان برای بازگرداندن عملکردهای ایمنی معکوس کرد.
استفاده مجدد از داروها برای درمان آلزایمر
در تحقیقی که به تازگی منتشر شده است، من و تیم من ارتباط جدیدی بین متابولیسم مختل گلوکز و بیماری های عصبی را کشف کردیم. این ما را بر آن داشت تا دارویی را که در اصل برای سرطان طراحی شده بود شناسایی کنیم که به طور بالقوه می تواند برای درمان آلزایمر استفاده شود.
ما بر روی آنزیمی به نام IDO1 تمرکز کردیم که نقش مهمی در اولین مرحله تجزیه اسید آمینه تریپتوفان ایفا می کند. این مسیر یک ترکیب کلیدی به نام کینورنین تولید می کند که مسیرهای انرژی اضافی و پاسخ های التهابی را تامین می کند. با این حال، کینورنین بیش از حد می تواند اثرات مضری داشته باشد، از جمله افزایش خطر ابتلا به آلزایمر.
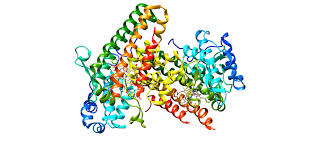
IDO1 یک بازیکن کلیدی در متابولیسم سلول های مغز است.
ما دریافتیم که مهار IDO1 میتواند حافظه و عملکرد مغز را در طیف وسیعی از مدلهای بالینی، از جمله در کشتهای سلولی و موش، بازیابی کند. برای درک دلیل، متابولیسم سلول های مغز را بررسی کردیم. مغز یکی از وابسته ترین بافت های بدن به گلوکز است. ناتوانی در استفاده صحیح از گلوکز برای سوخت فرآیندهای حیاتی مغز می تواند منجر به کاهش متابولیک و شناختی شود.
سطوح بالای IDO1
کاهش متابولیسم گلوکز با تولید کینورنین اضافی. بنابراین مهارکنندههای IDO1 - که در اصل برای درمان سرطانهایی مانند ملانوما، لوسمی و سرطان سینه طراحی شده بودند - میتوانند برای کاهش کینورنین و بهبود عملکرد مغز مورد استفاده قرار گیرند.
با استفاده از طیف وسیعی از مدلهای آزمایشگاهی، از جمله موشها و سلولهای بیماران آلزایمر، ما همچنین دریافتیم که مهارکنندههای IDO1 میتوانند متابولیسم گلوکز را در سلولهای مغز بازیابی کنند. علاوه بر این، ما توانستیم متابولیسم گلوکز را در موشهای دارای تجمع آمیلوئید و تاو - پروتئینهای غیرطبیعی که در بسیاری از اختلالات عصبی دخیل هستند - با مسدود کردن IDO1 بازیابی کنیم. ما بر این باوریم که استفاده مجدد از این مهارکنندهها میتواند برای اختلالات نورودژنراتیو مختلف مفید باشد.
ترویج پیری شناختی سالم تر
اثرات اختلالات عصبی و کاهش متابولیک بر افراد، خانواده ها و اقتصاد سنگینی می کند.
در حالی که بسیاری از دانشمندان بر روی هدف قرار دادن اثرات پایین دستی این بیماری ها، مانند مدیریت علائم و کند کردن پیشرفت تمرکز کرده اند، درمان زودتر این بیماری ها می تواند شناخت را با افزایش سن بهبود بخشد. یافتههای ما نشان میدهد که هدف قرار دادن متابولیسم نه تنها این پتانسیل را دارد که زوال عصبی را کاهش دهد، بلکه پیشرفت بیماریهای تخریبکننده عصبی مانند آلزایمر، پارکینسون و زوال عقل را نیز معکوس کند.
کشف بینش های جدید در تقاطع استرس، متابولیسم و پیری می تواند راه را برای پیری سالم تر هموار کند. تحقیقات بیشتر میتواند درک ما را از چگونگی تأثیر متابولیسم بر پاسخهای استرس و تعادل سلولی در طول زندگی بهبود بخشد.