تبریز امروز:
هنگامی که ویکتور آمبروس و گری روکون مولکولی جدیدی را کشف کردند که آنها را microRNA نامیدند در دهه 1980، این یک انحراف شگفتانگیز از چیزی بود که برای دههها جزم اصلی زیستشناسی مولکولی نامیده میشد.
آمبروس و روکون که با جایزه نوبل 2024 در فیزیولوژی یا پزشکی شناخته شدند، نوع جدیدی از ماده ژنتیکی را شناسایی کردند که نحوه درک محققان از تنظیم ژن را تغییر داد.
RNA مانند DNA، نیز شکلی از مواد ژنتیکی است که از نوکلئوتیدهای منفرد به هم متصل به زنجیره ساخته شده است. بر اساس جزم مرکزی، اطلاعات ژنتیکی در یک جهت جریان دارد: DNA به RNA رونویسی می شود و RNA به پروتئین ترجمه می شود. اما در یک انحراف عمده از جزم مرکزی، برخی از RNA ها هرگز به پروتئین ترجمه یا کدگذاری نمی شوند.
MicroRNA یکی از این RNA های به اصطلاح غیر کد کننده است. آنها امتداد کوتاهی از مواد ژنتیکی هستند که به جای کدگذاری برای یک پروتئین خاص، RNA هایی را که برای پروتئین ها کد می کنند، کنترل می کنند. در واقع، microRNA ها ژن های خاصی را روشن و خاموش می کنند.
ماموریت ما به اشتراک گذاری دانش و اطلاع رسانی تصمیمات است.
من حرفه علمی خود را به درک نحوه عملکرد RNA اختصاص دادم، تا حدی به این دلیل که تحقیقات روی RNA از سایر ماکرومولکولها مانند DNA و پروتئین عقب مانده است. به رسمیت شناختن مولکولهای microRNA با جایزه نوبل نشاندهنده اهمیت آنها در زیستشناسی و وعده آنها به عنوان درمانهای بالقوه برای بیماریهای مختلف از جمله سرطان است.
MicroRNA ها نقش کلیدی در تنظیم بیان ژن دارند.
میکرو RNA ها و بیماری
دانشمندان میکروRNA ها را به دلیل توانایی آنها در اتصال به بسیاری از RNA های کدکننده پروتئین و تغییر بیان آنها به عنوان تنظیم کننده اصلی ژنوم می دانند. در واقع، یک microRNA منفرد میتواند بین 10 تا 100 RNA کدکننده پروتئین را تنظیم کند. به جای ترجمه DNA به پروتئین، آنها می توانند به RNA های کدکننده پروتئین متصل شوند تا ژن ها را خاموش کنند.
دلیل اینکه microRNA ها می توانند چنین مجموعه متنوعی از RNA ها را تنظیم کنند، ناشی از توانایی آنها برای اتصال به RNA های هدفی است که کاملاً با آنها مطابقت ندارند. این بدان معناست که یک microRNA واحد اغلب میتواند مجموعهای از اهداف را تنظیم کند که همگی در فرآیندهای مشابه در سلول درگیر هستند و منجر به افزایش پاسخ میشوند.
از آنجایی که یک microRNA منفرد میتواند چندین ژن را تنظیم کند، بسیاری از microRNAها در صورت ناکارآمدی میتوانند در ایجاد بیماری نقش داشته باشند.
در سال 2002، محققان برای اولین بار نقش microRNAهای ناکارآمد در بیماری را از طریق بیماران مبتلا به نوعی سرطان خون و مغز استخوان به نام لوسمی لنفوسیتی مزمن شناسایی کردند. این سرطان ناشی از از دست دادن دو میکرو RNA است که معمولاً در مسدود کردن رشد سلول های تومور نقش دارند. از آن زمان، دانشمندان بیش از 2000 میکرو RNA را در افراد شناسایی کرده اند که بسیاری از آنها در بیماری های مختلف تغییر می کنند.
این زمینه درک نسبتاً محکمی از چگونگی نقش اختلال عملکرد microRNA در بیماری ایجاد کرده است. تغییر یک microRNA میتواند چندین ژن دیگر را تغییر دهد و در نتیجه تغییرات زیادی ایجاد کند که در مجموع میتواند فیزیولوژی سلول را تغییر دهد. به عنوان مثال، بیش از نیمی از سرطان ها به طور قابل توجهی فعالیت در یک microRNA به نام miR-34a را کاهش داده اند. از آنجایی که miR-34a بسیاری از ژن های دخیل در جلوگیری از رشد و مهاجرت سلول های سرطانی را تنظیم می کند، از دست دادن miR-34a می تواند خطر ابتلا به سرطان را افزایش دهد.
محققان به دنبال استفاده از microRNA ها به عنوان درمانی برای سرطان، بیماری های قلبی، بیماری های عصبی و غیره هستند. در حالی که نتایج آزمایشگاهی امیدوارکننده بوده است، آوردن درمانهای microRNA به کلینیک با چالشهای متعددی روبرو شده است. بسیاری از آنها مربوط به تحویل ناکارآمد به سلول های هدف و پایداری ضعیف هستند که اثربخشی آنها را محدود می کند.
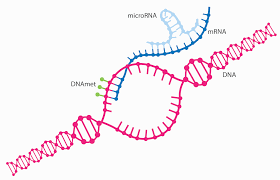
MicroRNA می تواند با اتصال به mRNA ژن ها را خاموش کند. کاجسا مولرسن/ویکیمدیا کامانز، CC BY-SA
انتقال microRNA به سلول ها
یکی از دلایلی که چرا تحویل درمانهای microRNA به سلولها دشوار است این است که درمانهای microRNA باید به طور خاص به سلولهای بیمار تحویل داده شود و در عین حال از سلولهای سالم اجتناب شود. برخلاف واکسنهای mRNA کووید-19 که با از بین بردن سلولهای ایمنی که وظیفه آنها شناسایی مادر خارجی است، جذب میشوند.
برای جلوگیری از حمله ایمنی و رسیدن به سلولهای مورد نظر، درمانهای microRNA باید بدن را فریب دهند که فکر کند خارجی نیستند.
دانشمندان در حال مطالعه روشهای مختلفی برای ارائه درمانهای microRNA به سلولهای هدف خاص خود هستند. یکی از روشهایی که توجه زیادی را به خود جلب میکند، به پیوند مستقیم microRNA به یک لیگاند، نوعی مولکول کوچک که به پروتئینهای خاصی در سطح سلولها متصل میشود، متکی است. در مقایسه با سلول های سالم، سلول های بیمار می توانند تعداد نامتناسبی از برخی پروتئین های سطحی یا گیرنده ها داشته باشند. بنابراین، لیگاندها می توانند به microRNA ها به طور خاص به سلول های بیمار کمک کنند و در عین حال از سلول های سالم اجتناب کنند. اولین لیگاند تایید شده توسط سازمان غذا و داروی ایالات متحده برای تحویل RNA های کوچک مانند microRNA ها، N-acetylgalactosamine یا GalNAc، ترجیحا RNA ها را به سلول های کبدی تحویل می دهد.
شناسایی لیگاندهایی که می توانند RNA های کوچکی را به سلول های دیگر برسانند، مستلزم یافتن گیرنده هایی است که در سطوح به اندازه کافی بالا در سطح سلول های هدف بیان می شوند. به طور معمول، بیش از یک میلیون نسخه در هر سلول برای رسیدن به تحویل کافی دارو مورد نیاز است.
یکی از لیگاندهای برجسته فولات است که به آن ویتامین B9 نیز می گویند، یک مولکول کوچک که در دوره های رشد سریع سلولی مانند رشد جنین حیاتی است. از آنجایی که برخی از سلول های تومور دارای بیش از یک میلیون گیرنده فولات هستند، این لیگاند فرصت کافی برای ارائه RNA درمانی کافی برای هدف قرار دادن انواع مختلف سرطان را فراهم می کند. برای مثال، آزمایشگاه من یک مولکول جدید به نام FolamiR-34a - فولات مرتبط با miR-34a - ایجاد کرد که اندازه تومورهای سرطان سینه و ریه را در موش کاهش داد.
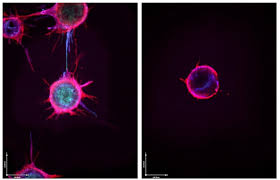
تصویر میکروسکوپی که سلولهای اندوتلیال را در کنار هم قرار میدهد تا رگهای خونی جدید را تشکیل دهند و سلولی غرق در microRNA که قادر به جوانه زدن نیست.
تومورها میتوانند از سلولهای سالم برای رشد رگهای خونی استفاده کنند که مواد مغذی برای آنها فراهم میکند، همانطور که در سلولهای اندوتلیال به سمت چپ جوانهزنی دیده میشود. با این حال، قرار دادن این سلولها در معرض میکروRNAهای خاصی، میتواند رشد را غیرفعال کند، همانطور که در سلول سمت راست دیده میشود. آزمایشگاه دادلی، دانشکده پزشکی دانشگاه ویرجینیا/NIH از طریق فلیکر، CC BY-NC
پایدار کردن microRNA ها
یکی از چالش های دیگر استفاده از RNA های کوچک، پایداری ضعیف آنهاست که منجر به تخریب سریع آنها می شود. به این ترتیب، درمان های مبتنی بر RNA عموماً در بدن کوتاه مدت هستند و برای حفظ اثر درمانی به دوزهای مکرر نیاز دارند.
برای غلبه بر این چالش، محققان RNA های کوچک را به روش های مختلف اصلاح می کنند. در حالی که هر RNA به یک الگوی اصلاحی خاص نیاز دارد، تغییرات موفقیت آمیز می تواند به طور قابل توجهی پایداری آنها را افزایش دهد. این امر نیاز به دوز مکرر را کاهش می دهد و متعاقباً بار و هزینه درمان را کاهش می دهد.
به عنوان مثال، GalNAc-siRNA های اصلاح شده، شکل دیگری از RNA های کوچک، دوز را از هر چند روز به یک بار در هر شش ماه در سلول های تقسیم نشده کاهش می دهد. تیم من لیگاندهای فولات مرتبط با microRNAهای اصلاح شده را برای درمان سرطان ایجاد کرد که دوز را از یک روز در میان به یک بار در هفته کاهش داد. برای بیماری هایی مانند سرطان که در آن سلول ها به سرعت در حال تقسیم شدن و رقیق شدن سریع microRNA تحویل شده هستند، این افزایش فعالیت پیشرفت قابل توجهی در این زمینه است. ما پیشبینی میکنیم که این دستاورد توسعه بیشتر این microRNA مرتبط با فولات را به عنوان یک درمان سرطان در سالهای آینده تسهیل کند.
بسیاری از آزمایشگاهها در حال کار بر روی ابداع درمانهایی هستند که بر اساس اکتشافاتی که آمبروس و روکون، برندگان نوبل نوبل، دههها پیش انجام دادند، انجام میدهند. در حالی که هنوز کار قابل توجهی برای غلبه بر موانع مرتبط با درمانهای microRNA وجود دارد، واضح است که RNA به عنوان یک درمان برای بسیاری از بیماریها امیدوارکننده است.